Síndrome de Wolff-Parkinson-White: ¿intervenir siempre?
El síndrome de Wolff-Parkinson-White puede provocar potencialmente taquiarritmias malignas e incluso muerte súbita, por lo que es fundamental arribar al diagnóstico tempranamente y estratificar los riesgos.
Artículos
/ Publicado el 4 de agosto de 2025
Autor/a: Masihullah Barat, David Torres Barba, Gordon Ho.
Fuente: Cleveland Clinic Journal Of Medicine; Volume 92, Number 2, 2025. Wolff-Parkinson-White syndrome: Diagnostic and management strategies
| Introducción |
El síndrome de Wolff-Parkinson-White (WPW) es una afección cardíaca congénita poco frecuente en la que el paciente tiene una o varias vías accesorias a lo largo del borde auriculoventricular que lo predisponen a taquiarritmias potencialmente malignas. Suele presentarse con síntomas como palpitaciones, mareos, dificultad respiratoria, pre síncope y síncope (a menudo, el síntoma que lleva a buscar atención médica).
En casos raros, el primer signo o síntoma es la muerte súbita cardíaca, debido a una taquiarritmia maligna.
Se estima que el síndrome de WPW afecta 1 a 3 individuos por cada 1000 en el mundo. Del 10 % al 34 % de los pacientes con anomalía de Ebstein y el 0,4 % de los pacientes con miocardiopatía hipertrófica tienen síndrome de WPW. En la población general, se estima que la tasa de muerte súbita cardíaca es del 0,1 % anual para los pacientes con patrón de WPW (sin síntomas) y del 0,8 % anual en aquellos con síndrome de WPW (con síntomas).
| Las vías accesorias pueden provocar arritmias malignas |
En un corazón normal, los impulsos eléctricos son generados por el nódulo sinoauricular y viajan a través del nódulo auriculoventricular y luego por el haz de His y las ramas izquierda y derecha, lo que provoca la contracción de ambos ventrículos. El nódulo auriculoventricular retrasa el impulso eléctrico el tiempo suficiente para que las aurículas se contraigan y vacíen la sangre en los ventrículos, lo que facilita el correcto llenado ventricular, manteniendo el gasto cardíaco. También puede actuar como marcapasos dominante si falla el nódulo sinoauricular.
Algunas personas nacen con una vía accesoria, es decir, una ruta alternativa de conducción auriculoventricular que evita tanto el nódulo auriculoventricular como el sistema de His. Esto genera preexcitación, en la que los ventrículos se contraen prematuramente.
La vía accesoria hace que los pacientes sean vulnerables a 2 formas de arritmia:
• Arritmias reentrantes, como la taquicardia supraventricular reentrante, cuando los impulsos viajan hacia abajo por el nódulo auriculoventricular y luego son retrógrados (ascendentes) a través de la vía accesoria.
• Conducción acelerada de arritmias auriculares, ya que la vía accesoria, a diferencia del nódulo auriculoventricular, no retrasa el impulso eléctrico. Esta afección presenta un riesgo significativo en quienes tienen fibrilación auricular al transmitir la frecuencia auricular rápida directamente al ventrículo izquierdo, pudiendo provocar fibrilación ventricular y muerte súbita.
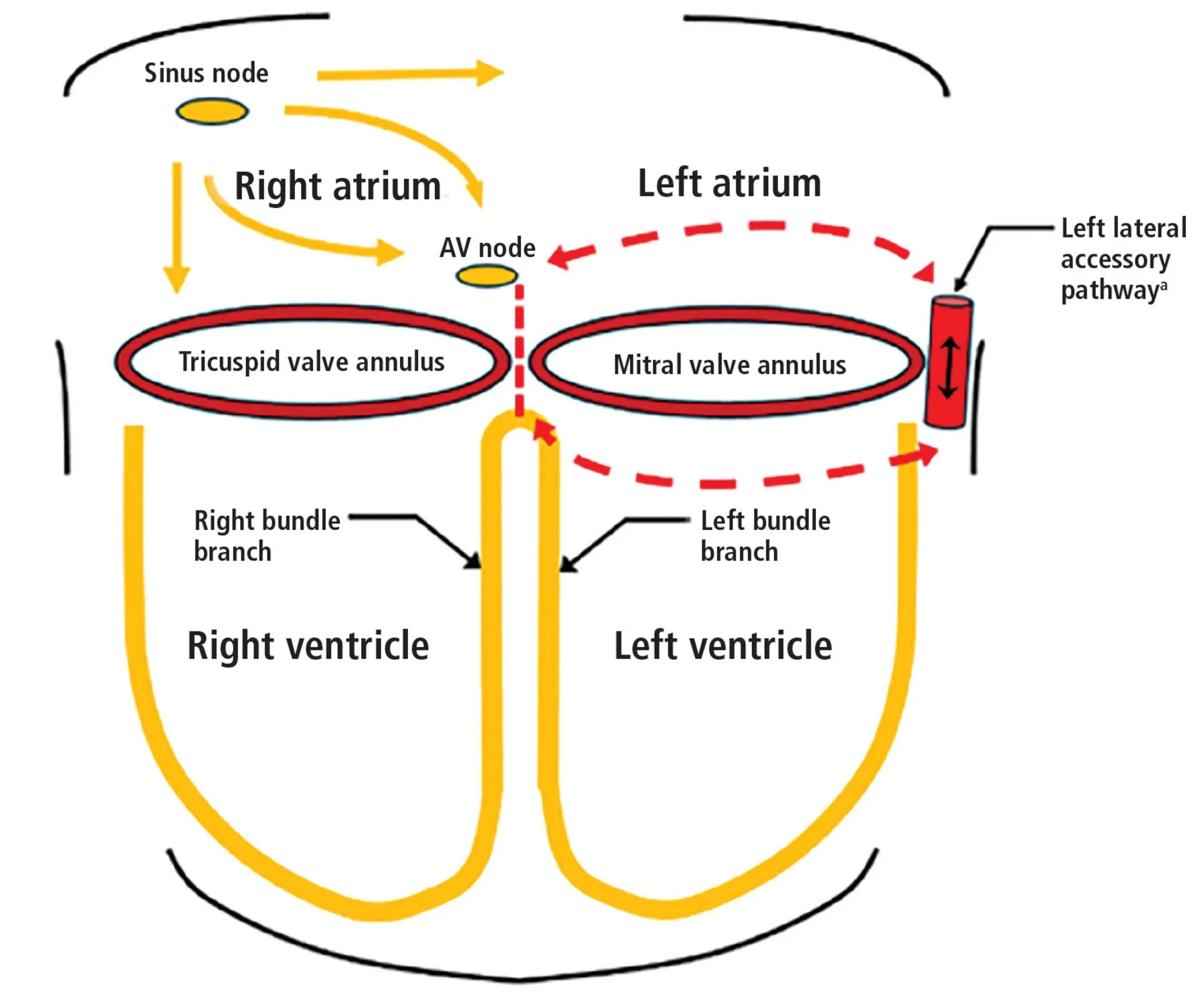
Sistema de conducción eléctrica con vía accesoria lateral izquierda. Una vía accesoria proporciona una vía de conducción auriculoventricular (AV) alternativa, evitando tanto el nódulo auriculoventricular como el sistema de His-Purkinje, lo que predispone a taquiarritmias malignas.
| Diagnóstico electrocardiográfico |
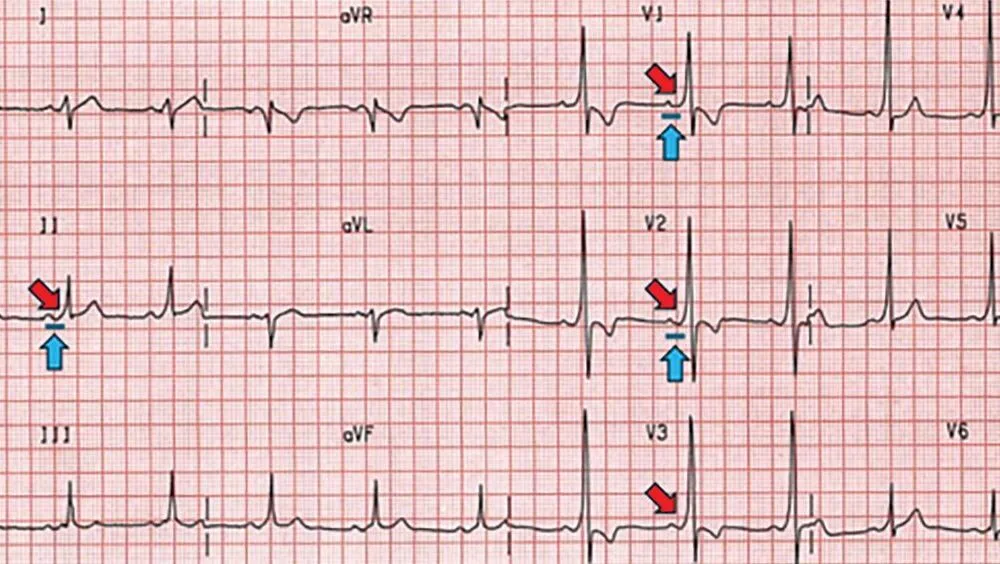
Una vía accesoria puede pasar desapercibida hasta el desarrollo de síntomas como palpitaciones, dolor torácico, dificultad respiratoria, mareos, aturdimiento y síncope asociado a arritmias. El electrocardiograma puede revelar el patrón distintivo de WPW: un intervalo PR corto (< 120 ms) y el hallazgo patognomónico de una onda delta (onda ascendente arrastrada del complejo QRS).
Tradicionalmente, los cardiólogos clasificaban los hallazgos electrocardiográficos en 2 tipos:
• Tipo A con ondas delta en las derivaciones septales (V1-V3), asociadas con una vía accesoria a la izquierda.
• Tipo B con ondas delta en las derivaciones laterales (V4-V6), asociadas a una vía accesoria a la derecha.
Sin embargo, las vías accesorias pueden existir en cualquier lugar a lo largo del borde auriculoventricular, dando patrones diferentes e incluso cambios de conducción que no son detectables en el electrocardiograma. Por lo general, ya no se clasifican las vías accesorias de WPW en función de las características A y B, pero estos patrones clásicos aún se describen en material educativo y de referencia, porque reflejan algunas de las ubicaciones de vías accesorias más comunes. No se describieron síntomas específicos ni presentaciones clínicas asociadas con un patrón específico de WPW o la localización de la vía accesoria.
El patrón de WPW se diagnostica en pacientes que no tienen síntomas, pero que sí tienen los signos electrocardiográficos mencionados, mientras que un diagnóstico de síndrome de WPW significa que el paciente tiene un patrón de WPW y síntomas relacionados con arritmias causadas por la vía accesoria.
Cabe destacar que un paciente puede tener una vía accesoria sin signos electrocardiográficos, ya que algunas vías se activan solo a frecuencias cardíacas específicas, en una dirección de conducción específica, o por impulsos generados por el ventrículo, como las contracciones ventriculares prematuras. Esto es importante, ya que los pacientes sin signos electrocardiográficos diagnósticos, pero con alta sospecha clínica, pueden beneficiarse con una consulta de cardiología después de una evaluación inicial.
| Estrategias de manejo |
La ablación con catéter tiene una recomendación de clase I (fuerte) en pacientes con síntomas y patrón de WPW (síndrome de WPW). La ablación con catéter tiene alta tasa de éxito (> 94 %) y baja tasa de complicaciones (< 1 %). Las tasas de recurrencia están cerca del 6,2 %.
El desafío del manejo radica en aquellos con patrón de WPW sin síntomas. Los objetivos son aliviar los síntomas relacionados con las taquiarritmias y prevenir la complicación más temida, la muerte súbita cardíaca.
Si bien es difícil predecir el riesgo de muerte súbita en estos pacientes, el riesgo es mayor en hombres, menores de 30 años, con antecedentes de fibrilación auricular, antecedentes familiares de síndrome de WPW, cardiopatías congénitas o profesiones de riesgo, como atletas competitivos, piloto de línea aérea o conductores profesionales.
> Estratificación de riesgo no invasiva
La estratificación de riesgo no invasiva puede ayudar a orientar la decisión de realizar una ablación con catéter. Un monitor de eventos cardíacos se puede usar 24 a 48 horas y ayuda a detectar una frecuencia cardíaca anormal, patrones de impulso eléctrico y también la preexcitación. El riesgo de muerte súbita cardíaca es mayor si el paciente tiene múltiples vías accesorias, mientras que la preexcitación intermitente en la que las ondas delta desaparecen intermitentemente incluso a frecuencias cardíacas normales sugiere un perfil de riesgo más bajo.
El ecocardiograma puede dilucidar el riesgo al detectar cardiopatías estructurales o congénitas subyacentes, ya que el síndrome WPW se asocia con anomalía de Ebstein y miocardiopatía hipertrófica.
La prueba de esfuerzo se utiliza para determinar si las ondas delta desaparecen de forma abrupta y persistente con el ejercicio, lo que sugiere un menor riesgo. Si bien esto puede ser tranquilizador, no garantiza que la fibrilación auricular no se lleve a cabo a través de esta vía.
Hay un subconjunto de pacientes que no se consideran de alto riesgo mediante pruebas no invasivas, pero cumplen criterios de alto riesgo mediante estudio electrofisiológico. Por lo tanto, la pérdida de preexcitación mediante pruebas de esfuerzo puede no excluir por completo una vía accesoria.
> Pruebas invasivas (estudio electrofisiológico)
Los estudios electrofisiológicos son invasivos, involucran electrodos intracardíacos y catéteres para buscar y evaluar las características de las vías accesorias. Se considera que un paciente con WPW presenta un alto riesgo de muerte súbita cardíaca si la preexcitación persiste durante la fibrilación auricular inducida o si el intervalo RR más corto es inferior a 250 ms durante la estimulación auricular incremental, la contracción auricular prematura o cuando se está en fibrilación auricular.
Si bien las guías de la Sociedad Europea de Cardiología y la Asociación Americana del Corazón difieren en cuanto a los métodos de estratificación de riesgo, ambas recomiendan estudios invasivos en pacientes con mayor riesgo de muerte súbita, incluidos los atletas y aquellos cuya muerte repentina podría poner en peligro a otros como pilotos y conductores comerciales.
Es posible que más electrofisiólogos estén realizando estudios en pacientes con un patrón de WPW asintomático, independientemente de los hallazgos no invasivos. Se cree que el cambio de estrategia se debe a que los procedimientos se vuelven más seguros, con tasas de complicaciones más bajas. Dado el bajo riesgo y el potencial para una cura permanente a través de la ablación con catéter, existe un incentivo para identificar y manejar el síndrome de WPW de manera proactiva. Además, estudios recientes sugirieron que los pacientes pueden experimentar complicaciones potencialmente mortales del síndrome de WPW, incluso si no tienen síntomas o características de "alto riesgo" en estudios no invasivos, lo que proporciona una justificación para el enfoque actual de evaluar a los pacientes con estudio electrofisiológico para el riesgo de estratificación y considerar la ablación.
En 2015 se reportó que las tasas de mortalidad a largo plazo para los pacientes con patrón WPW eran bajas y comparables a las de un grupo control emparejado por edad y sexo; sin embargo, los pacientes con patrón de WPW asintomático que se sometieron a ablación tuvieron un menor riesgo de muerte que los que no lo hicieron. Esto demuestra la importancia del seguimiento y tratamiento cuidadosos de pacientes con patrón y síndrome de WPW, dada la posibilidad de complicaciones graves, incluso sin síntomas y características de alto riesgo.
Las vías accesorias pueden existir en cualquier parte del plano auriculoventricular, pero la mayoría están en el anillo de la válvula mitral lateral izquierda, seguido de la región posteroseptal, donde las tasas de éxito notificadas de la ablación con catéter son excelentes. Otras localizaciones de las vías accesorias se asocian con menor tasa de éxito, como las que rodean el seno coronario y en las regiones septal y septal media.
En los pacientes que permanecen asintomáticos y no requieren ablación, la observación con un tratamiento conservador es un enfoque aceptable. Sin embargo, dada la persistencia de la vía accesoria, deben evitarse los fármacos que bloquean la conducción a través del nódulo auriculoventricular (verapamilo, diltiazem, amiodarona, digoxina, adenosina o betabloqueantes) porque pueden predisponer a una conducción preferencial a través de la vía accesoria en caso de taquiarritmia auricular lo que puede resultar en un colapso hemodinámico.
