Autor/a: Shannon M. Fernando, Bruno L. Ferreyro, Martin Urner, Laveena Munshi, Eddy Fan CMAJ 2021 May 25;193:E761-8
| Introducción |
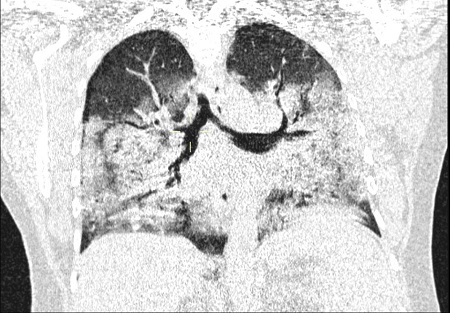
El síndrome de dificultad respiratoria aguda (SDRA) resulta en el aumento de la permeabilidad capilar alveolar y el desarrollo de edema pulmonar no hidrostático. Clínicamente, el síndrome de dificultad respiratoria aguda (SDRA) se manifiesta como una marcada hipoxemia y dificultad respiratoria.
A menudo, los pacientes progresan a insuficiencia respiratoria que requiere ventilación mecánica (VM) invasiva en la unidad de cuidados intensivos (UCI), con un riesgo de muerte elevado.
El SDRA puede estar causado por diversas afecciones, como la neumonía, la sepsis extrapulmonar o el shock séptico, el trauma y la pancreatitis.
A pesar de las pautas de consenso sobre el manejo del SDRA, sigue habiendo una gran variación en el manejo a nivel mundial y persistencia de lagunas en la evidencia, incluso en el contexto del SDRA asociado a COVID-19.
| ¿Qué es el SDRA y cómo se diagnostica? |
El SDRA se describió originalmente en 1967 como un síndrome clínico caracterizado por la aparición aguda de taquipnea, hipoxemia y pérdida de la distensibilidad pulmonar después de diversos estímulos; la descripción original también señaló que el SDRA no era sensible a los tratamientos habituales y ordinarios de la enfermedad respiratoria.
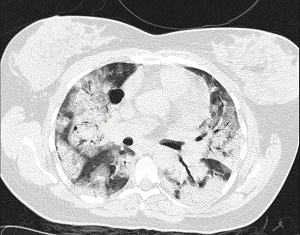
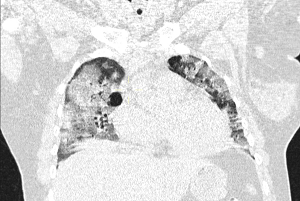
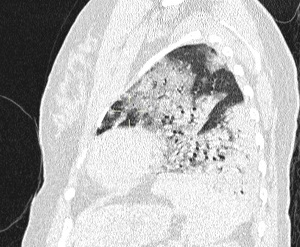
El sello distintivo de este síndrome es la inflamación pulmonar difusa, que da como resultado el desarrollo de edema pulmonar.
Morfológicamente, la fase aguda del SDRA se caracteriza por daño alveolar difuso. Los criterios de diagnóstico formales para el SDRA no fueron ampliamente aceptados hasta la American–European Consensus Conference (AECC), en 1994.
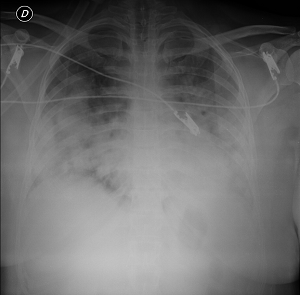
Los criterios de la AECC incluyen el inicio agudo de la hipoxemia, la presencia de infiltrados bilaterales no cardiogénicos en la radiografía de tórax, y la ausencia de hipertensión auricular izquierda. La hipoxemia se cuantificó utilizando la relación de la presión parcial de oxígeno arterial y la fracción de O2 inspirado (PaO2/FiO2), con una PaO2/FiO2 <200 mm Hg, necesaria para el diagnóstico de SDRA.
La definición de la AECC está limitada por varios factores: falta de un tiempo explícito de aparición, posible variabilidad de la radiografía de tórax interobservador y requisito de cateterismo de la arteria pulmonar para descartar la hipertensión auricular izquierda. Para abordar estas limitaciones, en 2012 se perfeccionaron los criterios clínicos para el diagnóstico del SDRA, danto lugar a la definición de Berlín.
Según esta definición, para hacer el diagnóstico de SDRA, el paciente debe tener síntomas nuevos o empeorar dentro de la primera semana de una agresión clínica conocida; debe tener opacidades bilaterales observables en la radiografía anteroposterior de tórax, no ocasionadas por derrame, nódulos o colapso lobular o pulmonar, e hipoxemia, definida por una PaO2/FiO2 <300 mm Hg y una presión positiva mínima al final de la espiración ≥ 5 cm H2O, que no se explica completamente por insuficiencia cardíaca o sobrecarga de líquidos.
La definición de Berlín también identificó categorías mutuamente excluyentes de la gravedad del SDRA, según el grado de hipoxemia: SDRA leve (PaO2/FiO2 200–300 mm Hg), moderado (PaO2/FiO2 100–200 mm Hg) y severo (PaO2 / FiO2 <100 mm Hg). Estas categorías se corresponden con el pronóstico. A mayor gravedad mayores son las tasas de mortalidad.
| ¿Cuál es la carga del SDRA? |
En el estudio de cohorte prospectivo LUNG SAFE se utilizó la definición de Berlín para identificar a los pacientes con SDRA ingresados en 459 UCI de 50 países de los 5 continentes.
En este estudio, el SDRA representó el 10,4% de todas las admisiones en UCI y el 23,4% de los pacientes que requirieron ventilación. Las causas más comunes del SDRA fueron la neumonía, la sepsis extrapulmonar, la aspiración y el trauma. La mediana de duración de la VM de los pacientes con SDRA fue 8 días (4–16 días).
El número de muertes fue sustancial; el 39,6% de los pacientes falleció en el hospital. Este porcentaje aumentó con la gravedad del SDRA (34,9%, 40,3% y 46,1% de los pacientes con enfermedad leve, moderada y grave, respectivamente).
Los datos administrativos muestran que, aunque en general las tasas de mortalidad del SDRA han disminuido en las últimas 2 décadas, todavía existen disparidades raciales y sexuales y los supervivientes tienen una morbilidad considerable.
Los sobrevivientes del SDRA muestran debilidad muscular y fatiga severas que persisten hasta 5 años después del alta hospitalaria, lo resulta en deterioro de la capacidad funcional y reducción de la tolerancia al ejercicio. Por otra parte, los supervivientes describen importantes secuelas psicológicas, cognitivas y económicas asociadas al SDRA.
| ¿Cuáles son los pilares terapéuticos? |
El estudio LUNG SAFE halló variaciones en el uso de pruebas basadas en tratamientos para el SDRA, en todos los centros de Europa. Pocas terapias están basadas en evidencia sólidas, pero en las últimas 2 décadas, se lograron importantes avances en el manejo del síndrome, particularmente en relación con la ventilación. Estos adelantos han SIDO incorporados posteriormente a las guías de práctica clínica.
| Ventilación mecánica |
La piedra angular del tratamiento del SRDA es la ventilación mecánica (VM) con protección pulmonar.
> Recomendaciones recientes para la práctica clínica
El objetivo terapéutico predominante es evitar la lesión pulmonar inducida por el ventilador, una forma iatrogénica de lesión pulmonar que empeora la inflamación y se asocia con malos resultados en pacientes que son ventilados mecánicamente. La lesión pulmonar ocurre cuando un estrés mecánico excesivo (por ej., volumen corriente elevado) provoca una respuesta inflamatoria (volutrauma), que puede propagarse a través de la circulación y conducir a la insuficiencia de órganos distantes (biotrauma).
Los ensayos aleatorizados han demostrado que la ventilación con un volumen tidal más bajo en relación con el peso corporal previsto y presiones de meseta límites dieron como resultado una gran mejoría de las tasas de mortalidad en los pacientes con SDRA. La VM con protección pulmonar tiene como desventaja, la posibilidad de crear hipercapnia y acidosis, las que en los caso leves y moderados pueden ser toleradas.
Las pautas existentes sugieren la consideración de niveles más elevados de presión positiva al final de la espiración en pacientes con SDRA moderado a grave. El mantenimiento de una presión positiva al final de la espiración más prolongada tiene la ventaja potencial de minimizar el colapso alveolar cíclico c y el cizallamiento pulmonar posterior. Sin embargo, el exceso de presión positiva al final de la espiración también puede afectar la hemodinámica y provocar una distensión pulmonar excesiva.
Se ha demostrado que esta terapia es eficaz solo en pacientes con SDRA moderado a grave. Otros métodos para mejorar la ventilación, como la ventilación oscilatoria de alta frecuencia, no han demostrado eficacia, y las guías recomienda no utilizarla rutinariamente en pacientes con SDRA. En los pacientes con SDRA leve se puede considerar la ventilación no invasiva, pero es poco probable que sea beneficiosa si la enfermedad es más grave.
En un metaanálisis reciente, se demostró que la oxigenoterapia por vía nasal con cánula reduce la necesidad de intubación y VM en pacientes con insuficiencia respiratoria hipoxémica aguda, pero no reduce las tasas de mortalidad.
> Posicionamiento en decúbito prono
La incidencia de lesión pulmonar inducida por el ventilador puede ser reducida colocando a los pacientes en decúbito prono.
La VM en decúbito supino puede resultar en atelectasia y bajo reclutamiento de las regiones pulmonares más dependientes.
La posición en decúbito prono redistribuye las fuerzas mecánicas a través del pulmón lesionado, lo que resulta en una inflación pulmonar más homogénea y reclutamiento de alvéolos en las regiones pulmonares dependientes.
Para los pacientes con SDRA y PaO2/FiO2 <150 mm Hg, hay evidencia de alta calidad que muestra que la posición en decúbito prono reduce el riesgo de muerte sin aumento de complicaciones graves. Por lo tanto, para los pacientes con SDRA grave, las guías recomiendan el uso rutinario de la posición prono.
> Soporte vital extracorpóreo
La oxigenación por membrana extracorpórea venovenosa (VV-ECMO, por sus siglas del inglés) ha surgido como una opción terapéutica para los pacientes con SDRA grave que sufrieron un deterioro a pesar de haberse optimizado otras terapias. Para estos pacientes, la VV-ECMO puede actuar como un puente para la recuperación.
La sangre desoxigenada se desvía a través de cánulas, desde la circulación sistémica a un pulmón de membrana extracorpórea que oxigena y elimina el dióxido de carbono de la sangre, devolviendo a la circulación la sangre oxigenada.
El uso de este soporte de intercambio de gases extracorpóreo permite el uso de presiones ventilatorias más bajas al pulmón lesionado, minimizando la lesión pulmonar inducida por el ventilador en pacientes gravemente enfermos. La indicación de VV- ECMO debe ser considerada en las primeras etapas del curso de la enfermedad del paciente, y no como último recurso.
| Terapia farmacológica |
Los corticosteroides se han estudiado mucho como terapia farmacológica para el SDRA. Teóricamente, actúan disminuyendo la inflamación pulmonar, y pueden reducir el riesgo de muerte en casos de SDRA graves.
Sin embargo, el uso de corticosteroides en pacientes críticos también se asocia con eventos adversos importantes, incluyendo hipernatremia, hiperglucemia y debilidad neuromuscular. Esta última puede ser devastadora para los pacientes con SDRA, y los médicos deben considerar y sopesar los riesgos potenciales. También se puede considerar la terapia complementaria con bloqueantes neuromusculares y sedación profunda para pacientes con SDRA que están recibiendo VM.
La liberación de volúmenes tidal regulares, bajos, puede ser difícil en los pacientes despiertos y con respiración espontánea (a menudo taquipneica), una situación conocida como desincronía del paciente ventilador. Por lo tanto, en el paciente en VM que sufre SDRA grave se ha probado el uso de sedación y bloqueo neuromuscular.
Los ensayos que estudiaron la indicación temprana del bloqueo neuromuscular en pacientes con SDRA son conflictivos. Sin embargo, puede ser considerado para optimizar la oxigenación y la ventilación, pero no está recomendado rutinariamente para todos los pacientes con SDRA moderado a grave.
También se han probado otros tratamientos farmacológicos con diversos niveles de éxito. Se ha demostrado que un manejo conservador, manteniendo el balance líquido mediante el uso de diuréticos reduce la duración de la VM y mejora la función pulmonar. Por lo tanto, se recomienda usarlos en forma rutinaria. Teóricamente, el óxido nítrico inhalado puede reducir la resistencia vascular y el desajuste ventilación-perfusión.
Los datos de estudios aleatorizados no solo muestran la falta de beneficio en la mortalidad si no también sugieren la producción de daño. Por último, se ha estudiado el uso de prostaciclina en aerosol para SDRA, pero se requieren más estudios de sus efectos antes de ser recomendada para su rutinario.
| ¿El SDRA asociado a COVID-19 es una entidad distinta? |
En 2020, la pandemia COVID-19 llevó el manejo del SDRA a los centros de atención. El desarrollo de SDRA secundario a COVID-19 grave era (y es) común, y no estaba claro si el SDRA asociado a COVID-19 era una entidad distinta de otras formas de SDRA, y si era necesaria una estrategia de manejo diferente. de los primeros informes surgieron las posibles estrategias alternativas para el SDRA asociado a COVID-19.
Se describieron 2 fenotipos de SDRA distintos entre pacientes con COVID-19:
1) Tipo H, marcado por la mayor elastancia pulmonar, mayor relación ventilación/perfusión, peso pulmonar elevado y capacidad de reclutamiento alveolar elevada (consistente con el SDRA severo típico) y,
2) Tipo L, recientemente descrito, marcado por valores bajos de las mismas variables.
Algunos expertos sugirieron que la mayoría de los pacientes con SDRA asociado a COVID19 se presentarían inicialmente con características de tipo L, y solo algunos pasarían al tipo H, por lo que se recomienda a los médicos indicar la intubación temprana en los pacientes con SDRA tipo L. Esto sugiere que estos pacientes pueden tolerar volúmenes tidal más elevados sin riesgo de lesión pulmonar inducida por el ventilador. Sin embargo, la evidencia acumulada no respalda esta caracterización del SDRA asociado a COVID-19.
Primero, los pacientes sin COVID-19 que cumplen con la definición de SDRA de Berlín tienen grados variables de elastancia pulmonar y reclutamiento alveolar. A pesar de esto, la identificación de fenotipos aún no es utilizada por los médicos a la hora de tratar el SDRA.
Segundo, los informes adicionales que evalúan la mecánica pulmonar de los pacientes con SDRA asociado a COVID-19 muestran que estos pacientes son similares a los pacientes con SRDA convencionales. De hecho, los fenotipos antes mencionados probablemente representen la evolución natural del SDRA. Por lo tanto, es probable que el uso de las terapias existentes basadas en la evidencia, que protegen los pulmones y evitan las lesiones iatrogénicas sean el mejor camino que seguir.
Aunque la evidencia futura puede cambiar los enfoques terapéuticos, en la actualidad no hay evidencia convincente que sugiera que el SDRA asociado a COVID-19 sea una entidad distinta, o que sea necesaria una estrategia alternativa de tratamiento, en particular con respecto a la ventilación. De hecho, las terapias que se utilizan comúnmente para el tratamiento del SDRA pueden ser eficaces para SDRA asociado a COVID-19.
Los pacientes con COVID-19 pueden beneficiarse de la ventilación no invasiva (cánula nasal de alto flujo) y la posición de decúbito del paciente despierto, ya que ambos parecen mejorar la hipoxemia y evitar la intubación.
Lo más notable es el uso de esteroides (principalmente dexametasona), que ha demostrado reducir las tasas de mortalidad entre pacientes con COVID-19 en VM.
Aunque el uso de tocilizumab, un anticuerpo monoclonal, puede ser eficaz para reducir la VM y la muerte en pacientes con COVID-19 hospitalizados, el uso de anticoagulación terapéutica entre pacientes con COVID-19 grave no parece aportar beneficios.
Finalmente, muchos pacientes con SDRA, ya sea asociado a COVID-19 o no, pueden requerir una duración prolongada de la VM. Por lo tanto, la traqueotomía puede ser necesaria y los médicos deben seguir las recomendaciones relacionadas con la seguridad, la conducción y el manejo de la traqueotomía.
| ¿Qué dudas persisten con respecto al manejo del SDRA? |
Aunque la ventilación con protección pulmonar, con modos tradicionales dirigidos a la presión o el volumen han sido la piedra angular del tratamiento del SDRA, los modos ventilatorios más nuevos también pueden ser eficaces.
Primero, la ventilación por liberación de presión de las vías respiratorias (APRV, por sus siglas en inglés) es un modo de ventilación con control de presión que puede minimizar la lesión pulmonar inducida por el ventilador. Este enfoque desinfla periódicamente los pulmones ("liberación") de un nivel más elevado de presión positiva continua en las vías respiratorias, en lugar de intentar inflar el pulmón para conseguir volúmenes pulmonares ideales, superando el cumplimiento deficiente con mayores presiones.
Teóricamente, manteniendo las presiones continuas en niveles moderados, la APRV puede reducir la lesión del pulmón inducida por el ventilador. Sin embargo, un ensayo aleatorizado reciente halló que la APRV no tuvo ningún impacto en las tasas de mortalidad del SDRA, aunque se asoció con menor duración de la VM y de la estancia en la UCI, en comparación con la ventilación con protección pulmonar controlada por volumen. El potencial de exacerbación del daño pulmonar auto-inducido por el paciente, o lesión pulmonar autoinfligida (P-SILI, por sus siglas en inglés) es otra área interesante de investigación.
Aun con el respaldo de una sólida justificación fisiológica, hay gran escasez de ensayos en seres humanos que permitan comprender el P-SILI. Teóricamente, el riesgo de P-SILI puede ser mitigado controlando el impulso y el esfuerzo respiratorio mediante del bloqueo neuromuscular, la sedación o el soporte vital extracorpóreo. En la actualidad hay poca evidencia de que el control del esfuerzo respiratorio y el impulso se asocien con mejores resultados en pacientes con SDRA.
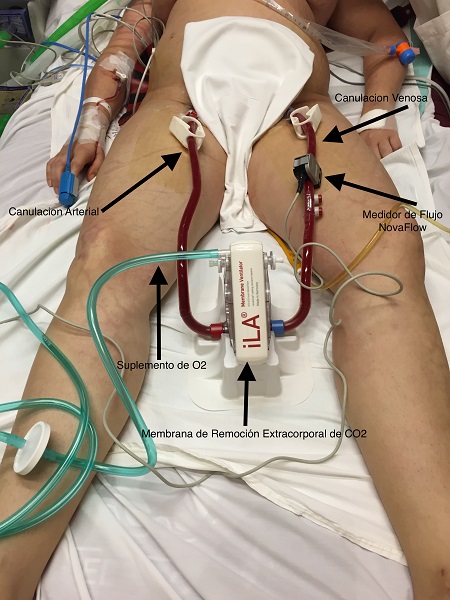
Finalmente, aunque la VV-ECMO es beneficiosa para pacientes con SDRA grave, en quienes el manejo convencional está fallando, existe otra forma novedosa de soporte vital extracorpóreo, que es la eliminación del dióxido de carbono; puede ser valiosa para el tratamiento del SDRA de moderado a grave. Los pacientes en VM con volúmenes corrientes muy bajos corren el riesgo de desarrollar hipoventilación e hipercapnia y acidosis. Al haber un método extracorpóreo para reducir el dióxido de carbono, se puede facilitar el mantenimiento de volúmenes tidal muy bajos.
A diferencia de la VV-ECMO, este método utiliza catéteres más pequeños, aunque hay importantes riesgos asociados, principalmente relacionados con el sangrado. Para los pacientes con SDRA moderado se puede considerar la eliminación extracorpórea del dióxido de carbono, para prevenir la progresión a una gravedad mayor.
Conclusión
|
Resumen y comentario objetivo: Dra. Marta Papponetti